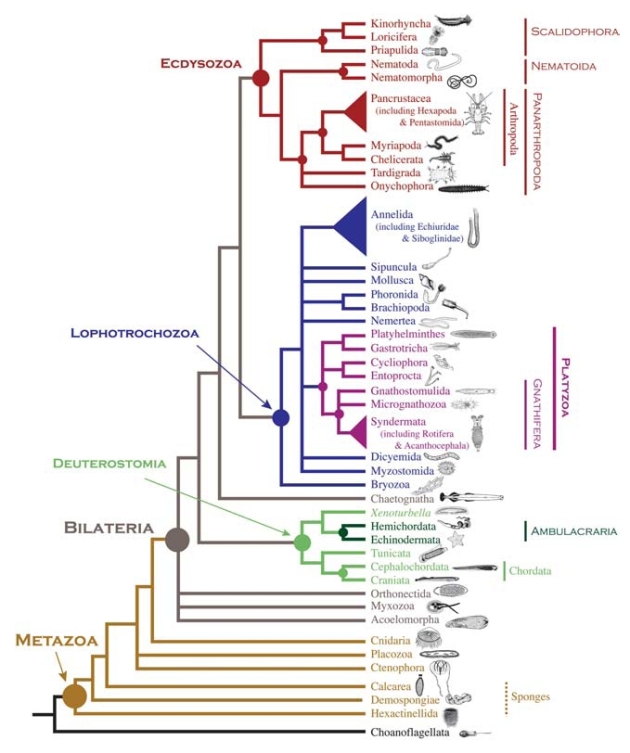
Os factores de stress ambiental do final do Pérmico, como a subida dos níveis de dióxido de carbono (CO2) atmosférico, aquecimento global, acidificação dos oceanos, anóxia, libertação de hidratos de metano, produção de compostos de enxofre tóxicos e destruição da camada de ozono criaram condições adversas o suficiente para levar à maior extinção em massa conhecida, estimando-se que cerca de 90% dos animais marinhos e 70% dos vertebrados terrestres se extinguiram. No entanto, olhamos para a Natureza que nos rodeia hoje em dia e dificilmente adivinharíamos que um cenário tão dantesco alguma vez ocorreu – esse é o grande testemunho da capacidade que a Vida tem para recuperar de épocas de crise, mesmo das mais violentas. A recuperação da grande extinção do Pérmico, durante o período Triássico, foi no entanto longe de fácil!
A recuperação de uma extinção em massa pode ser vista em parte como semelhante ao processo de sucessão ecológica, considerando-se como ecossistema recuperado aquele que é estável, embora a sua composição após uma extinção em massa tenda a ser bastante diferente relativamente à original. Tal como na sucessão ecológica, há organismos sobreviventes que aproveitam a falta de competição para se expandirem significativamente, e tal aconteceu no início do Triássico: o dicinodonte Lystrosaurus, já presente no final do Pérmico, torna-se de súbito extremamente abundante em todo o mundo, correspondendo a cerca de 90% de todos os fósseis de vertebrados terrestres. Os bivalves, sobretudo os do género Claraia, tornam-se muito abundantes no mar, substituindo os antes dominantes braquiópodes. Os poucos organismos do Triássico inicial são geralmente animais pequenos, o que sugere que o menor tamanho poderá ter sido um factor que ajudou à sobrevivência.

Lystrosaurus, Lystrosaurus, Lystrosaurus, Lystrosaurus... a monotonia do início do Triássico - Fonte: John Sibbick
Estes foram sendo gradualmente substituídos por espécies maiores à medida que as comunidades se foram diversificando de novo. Esta diversificação foi bastante lenta no entanto, e só no Triássico Superior, 30 Ma após o final do Pérmico, é que as comunidades de vertebrados terrestres apresentavam uma diversidade semelhante à anterior à extinção.
A questão da recuperação das comunidades vegetais é controverso. Uma das características da extinção do Pérmico é o aparecimento de um pico de esporos de fungos nos estratos correspondentes à época da extinção (quase 100% do total de vestígios de esporos e pólen, comparado com 10% comparado com os níveis pré e pós-extinção); estes corresponderiam aos sobreviventes da devastação, que começaram o processo de degradação de matéria morta e colonizaram o terreno desocupado, à semelhança do que acontece hoje em dia em locais devastados por erupções vulcânicas. No entanto, esta interpretação não reúne consenso, e em vários locais do mundo há vestígios de outros possíveis colonizadores primários, como musgos ou fetos.

Um representante actual do género Isoetes. "Fetos" como este dominaram a paisagem pós-Pérmico - Fonte: Gulf South Research Corporation
O padrão de extinção e recuperação observados nas comunidades vegetais preservadas no Sul da China apontam para uma situação bastante diferente da indicada pela extinção dos animais e pelo suposto pico de abundância de fungos. O declínio foi muito mais prolongado, tendo começado antes do fim do Pérmico e só terminado no Triássico Médio, numa duração de 23 Ma; em contrapartida, este declínio menos abrupto, e com flutuações no nível de extinção, sugere que as comunidades vegetais terrestres sofreram um grande evento de modificação na sua estrutura, ao invés de uma verdadeira extinção em massa.
No meio dos registos de seres vivos mais visíveis surgem evidências do registo sedimentar que organismos mais pequenos também sofreram uma grande influência da extinção do Pérmico. Formações microbianas como os estromatólitos e trombólitos, bastante características de mares muito mais antigos do Proterozóico, tornam-se de novo bastante comuns no Triássico inicial, associados a novos eventos de anóxia.
O facto de a Vida ter eventualmente recuperado, mesmo que lentamente, da extinção do Pérmico demonstra que quando o principal causador de mudanças ambientais deixa de estar activo, neste caso o grande vulcanismo dos traps da Sibéria, as condições ambientais acabam por estabilizar e permitir que os seres vivos se adaptem e diversifiquem, reocupando os nichos ecológicos deixados vagos. A extinção do Pérmico permitiu que novos grupos ocupassem os nichos mais visíveis, e embora não tivesse sido directamente responsável, levou a que se criassem condições para surgirem os dinossauros, o grupo de vertebrados terrestres dominante durante a era Mesozóica que começou no Triássico.

Algumas espécies ainda dadas como criticamente ameaçadas, como o Saola (Pseudoryx nghetinhensis) podem já estar extintas - Fonte: WWF
Como referi no primeiro post desta série, fala-se muito de uma possível 6ª grande extinção, causada pela nossa espécie, que estará agora a decorrer. No meio de tanto debate e incerteza sobre os reais efeitos que as nossas acções sobre o ambiente causam, é aconselhável dar uma olhadela ao passado para tentar perceber o que é que o futuro nos pode trazer.
Cálculos que comparam a magnitude e ritmo de extinção de vertebrados actuais com as cinco extinções em massa do passado revelam que, se considerarmos que as espécies actualmente ameaçadas se extinguirão num prazo de 100 anos, teremos uma extinção da magnitude de uma extinção em massa dentro de 240-540 anos; mesmo se formos mais conservadores e assumirmos um ritmo menor de extinção, assumindo que só as espécies criticamente ameaçadas se extingam nos próximos 100 anos (o que ao ritmo actual é bastante provável), podemos ter uma extinção em massa dentro de 890-2300 anos.
A principal alteração causada pelas erupções siberianas foi o aumento muito rápido dos níveis de CO2 na atmosfera e oceanos, que levou à acidificação dos oceanos e contribuiu para o agravamento das condições de anóxia nestes. Para além disso, o CO2 levou a um aumento de temperatura, devido à formação de um efeito de estufa, que levou à libertação de hidratos de metano dos fundos oceânicos, que por sua vez aumentaram ainda mais o efeito de estufa… Este aumento dos níveis de CO2 foi problemático porque a velocidade de adição deste à atmosfera ultrapassou a capacidade normal que o nosso planeta tem de o reciclar. E se tomarmos em consideração que estamos a adicionar anualmente cerca de 7 mil milhões de toneladas (7 Gt) de carbono à atmosfera, quando o ritmo calculado para o final do Pérmico era de 0,018 Gt por ano…
Por um lado, temos que ter em atenção que o contexto histórico é completamente diferente. Quando os traps da Sibéria se formaram o mundo já estava em prolongado aquecimento, os níveis de CO2 atmosféricos já eram muito altos e a circulação das correntes oceânicas estava já bastante afectada. Por outro, o ritmo a que estamos a provocar estas alterações é bastante mais rápido que o ritmo a que as alterações se deram no Pérmico, e mesmo que a queima de combustíveis fósseis e libertação de CO2 para a atmosfera cesse a médio prazo, este ficará durante muitos anos na atmosfera, aquecendo o planeta, pondo também em risco a libertação das extensas reservas de metano acumuladas no fundo do oceano.

O aumento recente da temperatura associada com o aumento de concentração de CO2 na atmosfera - Fonte: Michael Ernst
O registo geológico oferece-nos uma janela priveligiada para o passado, e dá-nos boas pistas para percebermos como o mundo poderá evoluir se seguirmos o nosso caminho de exploração descontrolada dos recursos naturais. No entanto, não é uma bola de cristal, e embora muitos dos processos de degradação ambiental sejam semelhantes, o motor dessa mudança é completamente diferente, o que torna as previsões difíceis.
E como diz o paleontólogo britânico Michael J. Benton no seu livro sobre a extinção do Pérmico (“When Life Nearly Died“), mesmo que não tenhamos níveis de extinção semelhantes aos das grandes extinções do passado, isso dificilmente será razão para nos congratularmos…
.
A grande extinção do final do Pérmico – parte 1
A grande extinção do final do Pérmico – parte 2
A grande extinção do final do Pérmico – parte 3
.
Referências
– Barnosky AD, Matzke N, Tomiya S, Wogan GO, Swartz B, Quental TB, Marshall C, McGuire JL, Lindsey EL, Maguire KC, Mersey B, & Ferrer EA (2011). Has the Earth’s sixth mass extinction already arrived? Nature, 471 (7336), 51-7 PMID: 21368823 (link)
– Benton, M., & Twitchett, R.J. (2003). How to kill (almost) all life: the end-Permian extinction event Trends in Ecology & Evolution, 18 (7), 358-365 DOI: 10.1016/S0169-5347(03)00093-4 (link)
– Sahney, S., & Benton, M. (2008). Recovery from the most profound mass extinction of all time Proceedings of the Royal Society B: Biological Sciences, 275 (1636), 759-765 DOI: 10.1098/rspb.2007.1370 (link)
– Saunders, A., & Reichow, M. (2009). The Siberian Traps and the End-Permian mass extinction: a critical review Chinese Science Bulletin, 54 (1), 20-37 DOI: 10.1007/s11434-008-0543-7 (link)
– Wignall, P (2008) The End-Permian crisis, aftermath and subsequent recovery , In: Okada; H; Mawatari; F, S; Suzuki; N; Gautam; P (Ed) Origin and Evolution of Natural Diversity, 21st Century for Neo-Science of Natural History , Hokkaido University, pp.43-48 (link)
– Xiong, C. & Wang, Q. (2011) Permian–Triassic land-plant diversity in South China: Was there a mass extinction at the Permian/Triassic boundary? Paleobiology, 37(1), 2011, pp. 157–167 (link)